公司: Samsung Bioepis Co., Ltd.
批准日期: 2021 年 9 月 17 日
治疗:黄斑变性、黄斑水肿、近视脉络膜新生血管
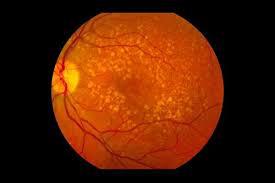
Byooviz (ranibizumab-nuna) 是一种血管内皮生长因子 (VEGF) 抑制剂,与 Lucentis 生物类似,用于治疗新生血管(湿性)年龄相关性黄斑变性 (AMD)、视网膜静脉阻塞 (RVO) 后的黄斑水肿和近视性脉络膜新血管化 (mCNV)。
(FDA)已批准 Byooviz(ranibizumab-nuna) ,一种引用 Lucentis®(雷珠单抗)i的生物
仿制药,用于治疗新生血管(湿性)年龄相关性黄斑变性 (AMD)、视网膜静脉阻塞 (RVO) 后的黄斑水肿和近视脉络膜新生血管 (mCNV)。
雷珠单抗是一种抗血管内皮生长因子 (VEGF) 疗法,可预防视网膜血管疾病患者的视力丧失,这些疾病可导致美国 (US) 成人不可逆的失明或视力障碍。ii,iii,iv,v
Byooviz™ 是第一个在美国获得批准的眼科生物
仿制药。生物仿制药是已被证明在功效和安全性上与原研药参考产品相似的产品,其优势在于它们可以节省成本并促进可持续的治疗。vi从 2020 年到 2024 年,未来五年美国生物仿制药的节省预计将超过 1000 亿美元。七
“在美国,大约有 1100 万人受到 AMD 的影响,并且由于人口老龄化,晚期 AMD 的患病率正在增加。美国第一个雷珠单抗生物仿制药的批准对于患有视网膜血管疾病的人来说是一个里程碑式的里程碑。美国,”三星 Bioepis 高级副总裁兼开发部门负责人 Kyung-Ah Kim 说。“ Byooviz 的批准强调了我们继续致力于为世界各地无法获得增强生命的生物药物的人提供有价值的治疗选择,”她补充道。
“我们很高兴能够在美国获得 Byooviz 的批准,开启新的篇章。这一批准代表了朝着解决美国视网膜血管疾病患者衰弱疾病进展的新治疗方案迈出的一大步,”百健高级副总裁兼生物仿制药全球负责人 Ian Henshaw 说。“生物仿制药可以帮助扩大患者获得更负担得起的治疗的机会,并节省医疗保健费用,以抵消这些复杂疾病不断上涨的成本,同时确保医疗保健系统的可持续性。”
除美国批准外,Byooviz™在欧洲获得批准,包括27个欧盟(EU)成员国于2021年8月18日和英国于2021年8月31日获得批准。
三星 Bioepis 和 Biogen 于 2019 年 11 月就两个眼科生物仿制药候选药物 SB11(一种引用 Lucentis ®(雷珠单抗)的生物仿制药候选药物)和 SB15(一种引用 EYLEA®viii(阿柏西普)的生物仿制药候选药物)签署了商业化协议。 由三星 Bioepis 开发,SB11 Biogen 将在美国以 Byooviz™ 品牌进行商业化。根据与基因泰克签订的全球许可协议,三星 Bioepis 和百健将在 2022 年 6 月(即基因泰克适用的 SPC 到期之前)以及基因泰克的 SPC 到期后在其他地区的其他地区自由销售 SB11。
FDA 对 Byooviz ™的批准基于包括分析、非临床数据和临床数据在内的全部证据。在 SB11 的一项随机、双盲、平行组、多中心 3 期研究中,将 SB11 与参考雷珠单抗在湿性 AMD 患者中的疗效、安全性、药代动力学和免疫原性进行了比较。705 名患者随机 (1:1) 接受每月注射 SB11 或参考雷珠单抗 (0.5 mg),634 名患者继续接受治疗直至第 48 周。 最佳矫正视力 (BCVA) 的最小二乘 (LS) 平均变化) 在第 52 周,SB11 与基线相比为 9.79 个字母,而参考雷珠单抗为 10.41 个字母(差异:-0.62,[90% CI:-2.092,0.857])。SB11 与 -124 的中央子场厚度 (CST) 的 LS 平均变化为 -139.55 μm。参考雷珠单抗为 46 μm(差异:-15.09,[95% CI,-25.617,-4.563])。直至第 52 周的所有时间点,PK、安全性(包括治疗中出现的不良事件的发生率)以及 SB11 和参考雷珠单抗的免疫原性特征均具有可比性。
Byooviz™(ranibizumab-nuna)是继 2017 年 4 月 Renflexis®(英夫利昔单抗-abda)、2019 年 1 月 Ontruzant®(
曲妥珠单抗-dttb)、Eticovo®(依那西普-ykro ) 于 2019 年 4 月,Hadlima ™ (adalimumab-bwwd) 于 2019 年 7 月。
请参阅下面的 Byooviz™ 的完整适应症和重要安全信息。
关于 Byooviz™ (ranibizumab-nuna)
Byooviz™ 在美国获批用于以下适应症:
新生血管(湿性)年龄相关性黄斑变性 (AMD)
视网膜静脉闭塞 (RVO) 后黄斑水肿 (RVO)
近视性脉络膜新生血管 (mCNV)
选择重要安全信息
警告和注意事项
玻璃体内注射后可能发生眼内炎和视网膜脱离。注射后应监测患者。
已经注意到玻璃体内注射前和后眼内压 (IOP) 的增加。
在玻璃体内使用 VEGF 抑制剂后,存在发生动脉血栓栓塞事件的潜在风险。
关于新生血管(湿性)年龄相关性黄斑变性 (AMD)
年龄相关性黄斑变性 (AMD) 是导致 50 岁以上成人不可逆失明的主要原因。仅在美国就有大约 1100 万人受到 AMD 的影响。80% 到 90% 的 AMD 相关失明是由湿性 AMD 造成的。三、九
关于视网膜静脉阻塞 (RVO) 后的黄斑水肿 视网膜
中央静脉阻塞 (RVO) 是导致视力丧失的视网膜疾病的常见原因。CRVO 的视力丧失通常是由黄斑水肿引起的,黄斑水肿是由于血管阻塞导致液体渗入黄斑(视网膜中心)时发生的。X
关于近视脉络膜新生血管 (mCNV)
近视是视力障碍的最常见原因之一,而近视最令人恐惧的并发症之一是脉络膜新生血管 (CNV) 的发展。近视 CNV 可发生在任何程度的近视患者身上,即使没有特征性的视网膜退行性改变。v
关于三星 Bioepis Co., Ltd. 三星 Bioepis
成立于 2012 年,是一家致力于实现人人可及的医疗保健的生物制药公司。通过产品开发的创新和对质量的坚定承诺,三星 Bioepis 旨在成为世界领先的生物制药公司。三星 Bioepis 继续推进广泛的生物仿制药候选产品管线,涵盖一系列治疗领域,包括免疫学、
肿瘤学、眼科、血液学、内分泌学和胃肠病学。


